|
Atomismo Cerca de 480 a.C.: Leucipo de Mileto, e Demócrito, de Abdera, elaboraram a hipótese de a matéria ser constituída por átomos. História da Física Prof.
Alberto Ricardo Präss  Muitos átomos apresentavam massas maiores
do que poderia explicar um modelo contendo apenas elétrons
e prótons, indicando a existência de um terceiro tipo de partícula sem
carga, e com massa aproximadamente igual a do próton. Em 1932,
James Chadwick anunciou a descoberta do nêutron, partícula
eletricamente neutra. O modelo próton-elétron cedeu lugar ao modelo próton-nêutron-elétron
que é usado até hoje. Neste modelo o átomo
é considerado como:
Muitos átomos apresentavam massas maiores
do que poderia explicar um modelo contendo apenas elétrons
e prótons, indicando a existência de um terceiro tipo de partícula sem
carga, e com massa aproximadamente igual a do próton. Em 1932,
James Chadwick anunciou a descoberta do nêutron, partícula
eletricamente neutra. O modelo próton-elétron cedeu lugar ao modelo próton-nêutron-elétron
que é usado até hoje. Neste modelo o átomo
é considerado como:
http://www.comciencia.br/reportagens/fisica/fisica08.htm  A ideia de átomo provavelmente é uma
das mais primitivas da física. Seu conceito foi originado pelos gregos, dando a
esta partícula o nome átomo, que em grego
significa “ indivisível”. O nome foi bem aceito até o início do século
XX, quando Einstein conseguiu mostrar que era possível partir um átomo e obter uma grande quantidade de energia, que pode ser muito útil no
fornecimento de energia elétrica a uma grande cidade, ou então nefasta quando
utilizada em bombas atômicas.
A ideia inicial dos gregos era de um átomo rígido e sólido. No entanto, já no
século XIX, vários físicos e químicos tentavam explicar o átomo como sendo constituído por outras partículas ainda menores, como:
A ideia de átomo provavelmente é uma
das mais primitivas da física. Seu conceito foi originado pelos gregos, dando a
esta partícula o nome átomo, que em grego
significa “ indivisível”. O nome foi bem aceito até o início do século
XX, quando Einstein conseguiu mostrar que era possível partir um átomo e obter uma grande quantidade de energia, que pode ser muito útil no
fornecimento de energia elétrica a uma grande cidade, ou então nefasta quando
utilizada em bombas atômicas.
A ideia inicial dos gregos era de um átomo rígido e sólido. No entanto, já no
século XIX, vários físicos e químicos tentavam explicar o átomo como sendo constituído por outras partículas ainda menores, como:
No final da década de 1930, foram descobertas partículas ainda menores, entre elas as denominadas múons, píons e káons. Hoje em dia, existe um número tão grande de partículas que nem o alfabeto grego foi suficiente para a denominação de todas elas. Desta forma, tais partículas são simplesmente associadas a números.
 Desde
o início do século 20 já se sabe que os átomos
não são os tais "tijolinhos" básicos de matéria
que, agrupados, constituiriam todas as coisas. Na verdade, eles mesmos
são estruturas feitas de objetos ainda menores. O estudo das propriedades
dessas partículas levou ao desenvolvimento do Modelo Padrão. Essa
teoria reconhece 12 elementos como fundamentais - isto é, não feitos de outras
coisas - e, a partir da interação entre eles, explica o comportamento
das quase 200 partículas já identificadas. O Neutrino
é uma dessas partículas fundamentais.
Desde
o início do século 20 já se sabe que os átomos
não são os tais "tijolinhos" básicos de matéria
que, agrupados, constituiriam todas as coisas. Na verdade, eles mesmos
são estruturas feitas de objetos ainda menores. O estudo das propriedades
dessas partículas levou ao desenvolvimento do Modelo Padrão. Essa
teoria reconhece 12 elementos como fundamentais - isto é, não feitos de outras
coisas - e, a partir da interação entre eles, explica o comportamento
das quase 200 partículas já identificadas. O Neutrino
é uma dessas partículas fundamentais.
Revista Galileu - Março 2003 nº 140, página 61 
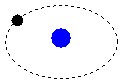
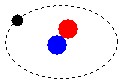
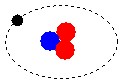
Os átomos são constituídos de prótons e elétrons, tecnicamente chamados de bárions. A matéria constituída de átomos é chamada de matéria bariônica.
Os blocos básicos de construção de matéria são átomos. Cada átomo consiste dum núcleo compacto, no qual reside praticamente toda a sua massa (exceto por uma pequena fração da mesma), rodeada por uma nuvem de partículas leves chamadas electrões. O raio dum átomo típico, referindo-se aqui ao raio até aos limites exteriores da sua nuvem de electrões é cerca de 10e-10 metros. Isto é cerca de dez mil vezes maior do que o raio do seu núcleo (o qual tem por volta de 10e-14 metros). O núcleo dum átomo típico consiste dum número de partículas pesadas e juntamente unidas (que são coletivamente chamadas nucleões. Os dois tipos de nucleão são:
Os electrões, que no modelo mais simples dum átomo podem ser visualizados como orbitando à volta do núcleo como planetas à volta do sol, têm cargas elétricas negativas; A carga negativa dum electrão é igual em magnitude, mas oposta no sinal, à dum protão. Um átomo completo, ou neutro, tem o mesmo número de electrões de carga negativa como de protões de carga positiva, e portanto tem uma carga total de zero, ou neutra; um átomo completo é portanto chamado um átomo neutro. Uma característica importante do núcleo é que ele determina o tipo químico do elemento que representa, por causa do número de protões que contém. o hidrogênio (símbolo químico, H) é o mais leve e o mais simples de todos os elementos químicos, e é também de longe o elemento mais abundante no universo. O núcleo dum átomo de hidrogénio consiste dum só protão e dum só neutrão. Hélio (símbolo químico, He) é o próximo elemento mais leve, e o segundo mais abundante, constituindo mais que 25% da matéria no universo. Um núcleo normal de hélio contém dois protões e dois neutrões. Por ele ter dois protões tem que ter dois electrões orbitando na nuvem à volta do núcleo para estar eletricamente neutro. Os núcleos mais pesados, como o do ferro ou do URÂNIO, contêm mais neutrões que protões, mas o número de electrões tem que ser sempre igual ao número de protões para o átomo estar eletricamente neutro. http://www.geocities.com Link desativado  Não obstante a teoria de Leucipo, o mentor de Demócrito, o qual,
quase cinco séculos antes do Cristo, considerava as coisas formadas de partículas infinitesimais , em constante movimentação, a cultura clássica
prosseguia detida nos quatro princípio de Aristóteles, ...
Não obstante a teoria de Leucipo, o mentor de Demócrito, o qual,
quase cinco séculos antes do Cristo, considerava as coisas formadas de partículas infinitesimais , em constante movimentação, a cultura clássica
prosseguia detida nos quatro princípio de Aristóteles, ...
Ou nos três elementos hipostáticos dos antigos alquimistas, ...
[28a - página 9]  Max Planck, distinto físico alemão, repara, em 1900, que o átomo,
em lançando energia, não procede em fluxo contínuo, mas sim por arremessos
individuais ou, mais propriamente, através de grânulos de energia,
estabelecendo a teoria dos « quanta de energia».
Max Planck, distinto físico alemão, repara, em 1900, que o átomo,
em lançando energia, não procede em fluxo contínuo, mas sim por arremessos
individuais ou, mais propriamente, através de grânulos de energia,
estabelecendo a teoria dos « quanta de energia».Foi então que Niels Bohr deduziu que a descoberta de Planck somente se explicaria pelo fato de gravitarem os elétrons, ao redor do núcleo, no sistema atômico, em órbitas seguramente definidas, a exteriorizarem energia, não girando como os planetas em torno do Sol, mas saltando, de inesperado, de uma camada para outra. E, procedendo mais por intuição que por observação, mentalizou o átomo como sendo um núcleo cercado, no máximo, de sete camadas concêntricas, plenamente isoladas entre si, no seio das quais os elétrons circulam livremente, em todos os sentidos. Os que se localizam nas zonas periféricas são aqueles que mais facilmente se deslocam, patrocinando a projeção de raios luminosos, ao passo que os elétrons aglutinados nas camadas profundas, mais jungidos ao núcleo, quando mudam de órbita deixam escapar raios mais curtos, a se graduarem na série dos raios X. Aplicada a teoria de Bohr em multifários setores da demonstração objetiva, ela alcançou encorajadoras confirmações, e, com isso, dentro das possíveis definições terrestres, o cientista dinamarquês preparou o caminho a mais amplo entendimento da luz. [29 - página 29]  O átomo é composto de
um ou mais elétrons, que giram em redor de um núcleo central; o que
individualiza o átomo e o distingue é
justamente o número desses elétrons que giram em torno do núcleo. Tendes,
assim, 92 espécies de átomos, desde o hidrogênio, que é o mais simples,
composto de um núcleo e de um só elétron que gira em torno dele; o Hélio (He), que o segue, composto de um núcleo e de dois elétrons; o Lítio (Li) com
três, e assim por diante até o URÂNIO (U), com 92 elétrons. Sobre essa base,
construiremos uma série
estequiogenética.
O átomo é composto de
um ou mais elétrons, que giram em redor de um núcleo central; o que
individualiza o átomo e o distingue é
justamente o número desses elétrons que giram em torno do núcleo. Tendes,
assim, 92 espécies de átomos, desde o hidrogênio, que é o mais simples,
composto de um núcleo e de um só elétron que gira em torno dele; o Hélio (He), que o segue, composto de um núcleo e de dois elétrons; o Lítio (Li) com
três, e assim por diante até o URÂNIO (U), com 92 elétrons. Sobre essa base,
construiremos uma série
estequiogenética.[63 - A GRANDE SÍNTESE - Constituição da matéria - Unidades múltiplas ] 
Numa simples gota d'água, existem cerca de 6.000.000.000.000.000.000.000 de átomos. http://www.sindicato.com.br/contren/atomo000.htm 
Representação de um elemento químico: ASbZA= número de massa = número de núcleons (prótons + nêutrons no núcleo)Sb: Símbolo químico do elementoZ= número atômico = número de prótons no núcleo. Um átomo representado desta forma é também chamado de nuclídeo.
|
Páginas relacionadas: